Autora: Sandra García
Las enfermedades priónicas son enfermedades neurodegenerativas letales y transmisibles que afectan a los mamíferos y cuya causa es un plegamiento aberrante de la proteína priónica celular (PrPC). El evento de malplegamiento de la PrPC da lugar a una estructura patógena llamada PrPSc, la cual es la causante de la enfermedad.
Los priones pueden ser transmitidos entre diferentes especies, por ejemplo; la encefalopatía espongiforme bovina (EEB), comúnmente llamada “mal de las vacas locas” que se transmite a la especie humana. El riesgo de transmisión a otras especies ha sido ampliamente estudiado, sobre todo en aquellas especies que se encuentran en estrecha relación con el ser humano. Sin embargo, existen especies que, a pesar de haber estado en contacto con priones, parecen ser resistentes a ellos y, por tanto, no desarrollan ninguna enfermedad.
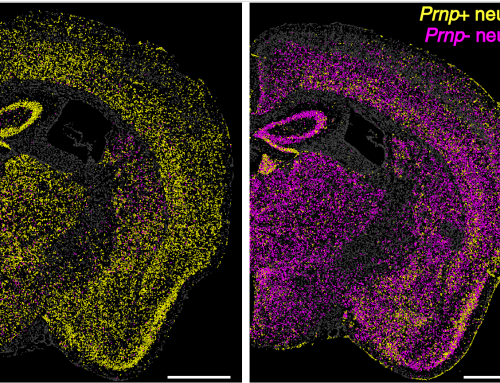
Algunos ejemplos de mamíferos que presentan muy baja susceptibilidad a los priones son: los cerdos, conejos, caballos y perros. Las características de las proteínas priónicas de estos animales han sido ampliamente estudiadas mediante el uso de modelos transgénicos. Estos modelos transgénicos se basan en ratones que expresan la PrPC de otro animal en el cerebro. Hasta el momento, los cánidos eran los únicos que no contaban con un modelo transgénico que ayudase a explicar su inusual resistencia a las enfermedades priónicas.
Investigadores del CIC bioGUNE, liderados por el Dr. Joaquín Castilla (Profesor IKERBasque), y del IRTA-CReSA, liderados por el Dr. Enric Vidal, han desvelado los mecanismos que pueden regir la resistencia de los perros a las enfermedades priónicas. El objetivo de este trabajo era explicar por qué los cánidos son las especies más resistentes estudiadas hasta la fecha. Para ello se generaron dos tipos de ratones transgénicos que modelaban la situación de los cánidos. Uno de los modelos contenía en su cerebro la misma proteína priónica que podemos encontrar en un perro, mientras que el otro expresaba una proteína de perro modificada para hacerla más parecida a la de los mamíferos susceptibles. Ambos modelos se inocularon con distintos priones para determinar su resistencia a la infección. Los resultados demostraron que ninguno de estos priones producía enfermedad en los ratones con la PrP idéntica a la de perro, mientras que el otro modelo animal con la PrP de perro con modificaciones fue susceptible y se infectó.
Este estudio ha revelado que una región concreta de la proteína priónica del perro parece ser la responsable de esta resistencia a los priones. Esto podría utilizarse para estudiar con más profundidad qué mecanismos controlan el malplegamiento de la PrPC que da lugar a la proteína priónica patógena en mamíferos, pudiendo aportar datos novedosos en un proceso que, hasta la fecha, sigue siendo una incógnita.
La principal dificultad del estudio ha radicado en poder afirmar con rotundidad que los ratones transgénicos generados que tenían la PrP canina en su cerebro, eran completamente resistentes a las enfermedades priónicas. Para ello, esos ratones fueron inoculados con numerosos priones para evaluar su susceptibilidad. Tras esperar el tiempo necesario, los ratones del grupo resistente se mostraron completamente asintomáticos. Este resultado fue respaldado por estudios histológicos post-mortem y con la aplicación de una técnica de detección de priones ampliamente utilizada en el campo. Ambas pruebas mostraron resultados negativos para la enfermedad priónica, demostrando definitivamente que los cánidos son resistentes a los priones debido a un único cambio en su PrPC.
Todo este trabajo de investigación ha servido para confirmar el fenómeno de resistencia a la infección por priones que presentan los cánidos y para abrir una puerta a futuros estudios que exploren nuevas aproximaciones terapéuticas para combatir las enfermedades priónicas en humanos basados en la particularidad que presenta la PrPC de los perros.
Puede ver el artículo original aquí.




Leave A Comment